作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 57 篇 doi: 10.5376/mpb.cn.2012.10.0057
收稿日期: 2012年04月26日 接受日期: 2012年05月08日 发表日期: 2012年12月15日
引用格式(中文):
王柬人等, 2012, 黄瓜ζ-胡萝卜素脱氢酶基因克隆及表达分析, 分子植物育种(online) Vol.10 No.57 pp.1414-1421 (doi: 10.5376/mpb.cn.2012.10.0057)
引用格式(英文):
Wang et al., 2012, Molecular Cloning and Expression Analysis of ζ-Carotene Desaturase Gene from Cucumis sativus L., Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.57 pp. 1414-1421 (doi: 10.5376/mpb.cn.2012.10.0057)
以西双版纳黄瓜为试材,从黄瓜果肉中克隆ζ-胡萝卜素脱氢酶(ZDS)基因的cDNA序列,命名为CsZds。获得目的片段长度为1 805 bp,该序列具有完整的开放阅读框,位于31~1 761 bp,编码576个氨基酸。序列比对分析结果显示,该蛋白在氨基端变化十分明显,中部较为保守,存在一个特征序列。系统进化分析表明,推测的CsZDS蛋白与南瓜中ZDS蛋白同源性最高,达到91.84%。利用实时荧光定量PCR技术分析结果显示,随着果实成熟期的延长,西双版纳黄瓜CsZds基因的表达量呈明显上升的趋势,在转色期达到最大。在果实发育过程中,西双版纳黄瓜CsZds基因的表达量高于普通黄瓜。
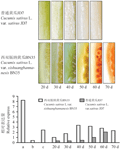
西双版纳黄瓜是我国特有的黄瓜变种资源,其果实形状为长圆形和近圆形,单果重一般2~3 kg,老瓜果肉和胎座均为橙色,胎座颜色最深,果实颜色由内向外逐渐变浅,与甜瓜相近(戚春章等, 1983)。分析表明,18份西双版纳黄瓜老瓜的平均β-胡萝卜素含量为106.58 mg/kg DW,是普通栽培黄瓜的近百倍,β-胡萝卜素的大量积累是果肉色形成的主要原因(沈镝, 2009)。
类胡萝卜素是植物中的重要色素,具有广泛的生物学功能。植物体中,类胡萝卜素代谢可促进激素ABA的生物合成,增强植物的多种抗逆反应(Fang et al., 2008; Schwartz et al., 2003);β-胡萝卜素是维生素A的前体物质,维生素A的缺乏会导致人的皮肤变厚、干燥、发生皱纹,增加患癌症、心脏病、眼疾等多种疾病的危险(Grune et al., 2010)。天然类胡萝卜素对于人体健康起着重要作用,能够猝灭自由基,延缓衰老,增强抵抗力,有防癌抗癌的功效(Palozza et al., 2002; Müller et al., 2002)。近年来,人们已从分子遗传和生理生化等方面对β-胡萝卜素生物合成途径的酶进行鉴定,并从分子水平对类胡萝卜素的主要生物合成途径进行了明确的阐述(Hirschberg, 2001; Fraser and Bramley, 2004; Romer and Fraser, 2005; DellaPenna and Pogson, 2006; Howitt and Pogson, 2006),为研究西双版纳黄瓜类胡萝卜素积累提供了重要参考。
ζ-胡萝卜素脱氢酶(ζ-Carotene desaturase, ZDS)是类胡萝卜素生物合成途径中的重要去饱和酶之一。它催化ζ-胡萝卜素发生两次脱氢反应,首先生成途径中的第一个有色分子—链孢红素,然后经过进一步催化作用转化成番茄红素,番茄红素是类胡萝卜素代谢途径的分歧点。目前已从胡萝卜、草莓、文心兰、甜橙、玉米等多种植物中克隆到Zds基因,在甜瓜属中对该基因的分离和鉴定尚未见报道。
本研究以西双版纳黄瓜为试材,克隆其果肉中CsZds基因进行相关序列分析,并研究该基因在转录水平的表达调控,旨在为探索西双版纳黄瓜果实类胡萝卜素积累的分子机制奠定基础,同时也为黄瓜营养品质的改良提供科学依据。
1结果与分析
1.1 CsZds基因cDNA序列的克隆
以ZdsF/ZdsR为引物进行PCR特异扩增,获得约1.8 kb的特异产物(图1)。对该片段进行回收纯化,连接到pEASY-T1载体上,筛选阳性重组子测序鉴定,该克隆片段长1 805 bp,为CsZds目标片段。
|
|
1.2 CsZds基因的序列分析
核苷酸测序结果显示,所得片段具有完整的开放阅读框,位于31~1 761 bp,编码576个氨基酸(图2)。推测蛋白质的相对分子式为C2879H4520N766O837S23,原子数为9 025,相对分子质量为63 993.5,理论等电点为6.77,不稳定系数为40.11,属于不稳定蛋白。
|
|
采用ProtScale对CsZDS蛋白质的疏水性进行分析(图3),整体来看,亲水性氨基酸和疏水性氨基酸在整个蛋白质中分布均匀,无明显的疏水区。TMHMM Server 2.0也并未预测到跨膜结构,推测该酶在黄瓜中可能不是膜结合蛋白。
|
|
导肽引导新合成的肽链进入细胞器,对于了解蛋白质的亚细胞定位与作用机制有一定意义,应用TargetP 1.1 Server预测CsZDS氨基酸序列导肽(表1),结果表明,该序列含有叶绿体转运肽。
|
|
蛋白质的多肽链通过折叠、螺旋、和卷曲形成比较稳定的空间结构,依据Geourjon和Deléage (1995)的方法,用SOPMA预测CsZDS氨基酸多肽链的二级结构(图4),发现无规则卷曲最多,为42.19%,分布较为均匀;其次是α-螺旋,为37.85%,主要集中在中部,延伸链为14.93%,β-转角最少,为5.03%,这4个二级结构构成CsZDS蛋白的基本结构。
|
|
对推测的CsZDS氨基酸序列进行CDD (conser- ved domain database)搜索,32~569位氨基酸区域与ζ-胡萝卜素脱氢酶蛋白域(PLN02487)高度同源,表明CsZds基因是ζ-胡萝卜素脱氢酶,且76~142位含有NADB-Rossmann superfamily保守结构域,说明该酶可能与NADP(H)等辅助因子相互作用(图5)。
|
|
1.3 CsZDS同源性分析和系统发育树构建
通过SWISSPORT数据库检索ZDS在不同植物中的蛋白序列,发现该蛋白在自然界广泛存在,ZDS催化合成类胡萝卜素是不同物种共同拥有的生物途径。将检索到的南瓜、水仙、番茄等28种植物的ZDS氨基酸序列及CsZDS推导的氨基酸序列利用MEGA4.0软件构建系统进化树(图6),ZDS蛋白分为两大类群,系属于单子叶植物和双子叶植物,同一科属物种的ZDS蛋白位于系统进化树的相同分支上,亲缘关系越近,相似系数越高,ZDS蛋白的进化与植物进化基本一致。推导的CsZDS氨基酸序列与同属葫芦科的南瓜序列进化关系最为相近,与小麦、玉米、文心兰等进化关系相对较远。
|
|
利用DNAMAN软件对黄瓜、南瓜、向日葵、胡萝卜、甜橙、草莓、番茄、拟南芥、玉米等9个物种的序列进行多序列比对,结果表明,不同物种中ZDS蛋白的同源性较高,仅在氨基端和羧基端的氨基酸呈现多样性的变化,氨基端的变化较为明显(图7)。CsZDS氨基酸序列中存在ζ-胡萝卜素脱氢酶的特征序列,该特征序列也存在于吡啶二硫核苷酸氧化还原酶多肽中(黄彬城等, 2006)。
|
|
1.4 CsZds相对定量表达分析
为了分析CsZds基因对西双版纳黄瓜果实成熟期β-胡萝卜素积累的作用,应用实时荧光定量PCR技术测定CsZds基因在西双版纳黄瓜不同组织器官及果实不同发育时期的表达量,结果见图8。从图中可以看出,在西双版纳黄瓜的不同组织器官中,CsZds基因均有表达,花中表达量最高,茎中最低,而在叶片及果实不同发育时期的表达量介于花和茎之间。
|
|
比较西双版纳黄瓜和普通黄瓜果实不同发育时期CsZds基因表达量的变化趋势,发现该基因在两份材料中均呈现随着生育期的延长表达量逐渐升高的趋势。西双版纳黄瓜果实授粉后20 d表达量显著低于其他时期,授粉后40 d达到最大值,而后逐渐下降。普通黄瓜果实CsZds基因在授粉后40 d之前表达量无明显差异,之后表达量明显上升,其上升的时期明显滞后于西双版纳黄瓜。从整体水平上看,普通黄瓜CsZds基因的表达量低于西双版纳黄瓜。
2讨论
Zds基因是类胡萝卜素生物合成途径中的重要酶基因之一,主要参与线状类胡萝卜素的生物合成,催化ζ-胡萝卜素向番茄红素的转化,促进分支途径其他类胡萝卜素的合成。分析目前已克隆的多种植物Zds基因,cDNA长度在1.6~1.8 kb,编码558~588个氨基酸,肽链长度变化较小。对Zds基因的序列特征分析结果显示有以下特性:Zds基因编码的蛋白质具有理论等电点在6.43~8.71,不稳定系数为36.93~ 45.96,含有NADB-Rossmann superfamily保守结构域,表明该酶存在NAD(H)结合位点,以NAD(H)作为电子受体或作为辅助因子。在本实验中,对克隆的黄瓜CsZDS氨基酸序列特征分析结果表明,该蛋白同样具有以上特性。多序列比对结果表明,不同物种中ZDS蛋白同源性很高,仅在氨基端和羧基端的氨基酸呈现多样性的变化,氨基端的变化更为明显,这与氨基端多为转运肽有关,因转运肽序列具有识别特异性,不同物种间转运肽的同源性较低。
目前,对于类胡萝卜素生物合成的研究主要集中在3个关键限速反应,包括牻牛儿基牻牛儿基焦磷酸的合成、八氢番茄红素的合成以及番茄红素的合成及代谢分解。ZDS是番茄红素合成的重要限速酶,对于类胡萝卜素的生物合成具有调控的作用。Yan等(2011)对不同品种的番木瓜果肉中Pds、Zds基因的表达量进行测定,发现番木瓜红色果肉和黄色果肉类胡萝卜素的积累差异与Pds、Zds的转录水平调控相关;Rodrigo等(2004)对柑橘果实不同时期类胡萝卜素生物合成相关基因的表达研究发现,Zds和Psy基因表达量上调明显,促进线性类胡萝卜素的合成,对柑橘果实颜色积累起重要的正调控作用;在烟草中过量表达Zds基因,使得烟草花中β-胡萝卜素提高49%,叶片中β-胡萝卜素含量提高91% (Ji et al., 2009)。在本研究中,CsZds基因在西双版纳黄瓜的花、叶片、茎、果实中均有表达,花中表达量最高,随着果实成熟期的延长,西双版纳黄瓜CsZds基因的表达量呈明显上升的趋势,在转色期达到最大,在果实发育过程中,其表达量明显高于普通黄瓜,推测CsZds基因可能与黄瓜果实β-胡萝卜素的积累及花的显色相关,西双版纳黄瓜果实在成熟过程中β-胡萝卜素大量积累的分子机制还有待进一步深入研究。
3材料和方法
3.1试验材料
供试材料为西双版纳黄瓜(Cucumis sativus L. var. xishuangbannanesis) BN35和普通黄瓜(Cucumis sativus L. var. sativus) JD7,于2010年8月种植于中国农业科学院南口试验农场的日光温室中。
3.2黄瓜RNA提取及cDNA克隆
选取BN35转色期果实(授粉后40 d),将果肉切成薄片,液氮速冻。采用TransGen EasyPureTM Plant RNA Kit试剂盒提取RNA,具体操作按照说明书进行,所提取的RNA经过1%琼脂糖凝胶电泳检测后进行逆转录反应。逆转录试剂盒SuperScript Ⅲ First-Strand Synthesis System for RT购自Invitrogen公司,以提取的总RNA为模板,按照说明书逆转录为cDNA。
以黄瓜全基因组数据库注释的Zds序列为参考,在开放阅读框之外设计一对特异引物,ZdsF:5'-ATCCATTCCTTTGTTCT-3';ZdsR:5'-CACTAT- GCCTCTGTGTTAC-3',以cDNA为模板进行PCR扩增。PCR所用的酶购自TransGen公司,PCR体系:10×TransStart Taq Buffer 2.5 mL (含20 mmol/L Mg2+),2.5 mmol/L dNTPs 2 μL,TransStartTM Taq DNA Poly- merase 0.5 μL,10 μmol/L上游引物0.5 μL,10 μmol/L下游引物0.5 μL,cDNA模板(20 ng/μL) 2 μL,加ddH2O补足到25 μL。PCR反应程序:94℃,5 min,变性94℃,30 s;退火56℃,30 s,延伸72℃,2 min,共35个循环,最后72℃延伸10 min,4℃冰箱保存。PCR产物经1%琼脂糖凝胶电泳检测,采用天根普通琼脂糖凝胶DNA回收试剂盒(离心柱型)按照说明进行回收,回收产物连入pEASY-T1 Clonging Vector,转化Trans1-T1感受态细胞,连接载体和感受态均购自于TransGen公司。蓝白斑筛选阳性克隆,经菌液PCR检测后,将阳性重组子送到中国农业科学院作物科学研究所重大科学工程楼开放实验室测序。
3.3 CsZds基因序列特征分析及系统进化树构建
采用Expasy网站ProtParam程序分析编码氨基酸的组成、分子量、理论等电点等理化性质,TMHMM Server 2.0分析跨膜区,ProtScale分析蛋白的亲水性、疏水性,TargetP 1.1 Sever预测蛋白的导肽,蛋白质的二级结构通过SOPMA在线分析获得,CDD (conserved domain database)进行氨基酸序列结构域分析,CsZds基因开放阅读框的分析、相应编码氨基酸序列的推导和多重序列比对均采用DNAMAN软件完成,MEGA4.0软件进行同源性分析,并用邻接法(neghbor-joining, NJ)构建系统进化树,所用ZDS蛋白序列来自SWISSPORT数据库。
3.4 CsZds基因表达分析
分别提取西双版纳黄瓜(BN35) 6个不同时期的果肉(授粉后20 d, 30 d, 40 d, 50 d, 60 d和70 d)、结果盛期的花、叶、茎,以及普通黄瓜(JD7) 5个不同时期的果肉(授粉后20 d, 30 d, 40 d, 50 d和60 d)总RNA,参照已克隆序列,设计CsZds基因的实时荧光定量引物qZdsF:5'-AATGGATGGGTGACAGAA-3';qZdsR:5'-CCTCGGGAGACGTTAGTG-3',内参基因Actin的特异性引物参照孙晓琦(2008)合成,ActinF:5'-CCACGAAACTACTTACAACTCCATC-3';Actin- R:5'-GGGCTGTGATTTCCTTGCTC-3'。RNA经1%琼脂糖凝胶电泳检测合格后,反转录成cDNA第一链。荧光定量试剂盒购自于TransGen公司的TransStartTM Green qPCR SuperMix,反应体系为:5 μL RT产物稀释液,0.5 μL引物,1×TransStartTM Green qPCR SuperMix,1×Passive Reference Dye/PCR Enhancer,终体积为25 μL,3次重复。在ABI Step One荧光定量PCR仪进行实时荧光定量PCR分析。反应程序为:95℃ 30 s,以激活TransStart Taq热启动酶,之后95℃ 5 s,55℃ 15 s,72℃ 10 s,40次循环。目标基因的相对表达水平采用2-△△CT法计算。
作者贡献
王柬人是本研究的实验设计和实验研究的执行人并完成数据分析,论文初稿的写作;李锡香、王海平、邱杨、宋江萍、张晓辉参与实验设计,试验结果分析;沈镝是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家自然科学基金项目(31071797)和农业部园艺作物生物学与种质创制重点实验室项目共同资助。
参考文献
DellaPenna D., and Pogson B.J., 2006, Vitamin synthesis in plants: tocopherols and carotenoids, Annu. Rev. Plant Biol., 57: 711-738
http://dx.doi.org/10.1146/annurev.arplant.56.032604.144301 PMid:16669779
Fang J., Chai C., Qian Q., Li C., Tang J., Sun L., Huang Z., Guo X., Sun C., Liu M., Zhang Y., Lu Q., Wang Y., Lu C., Han B., Chen F., Cheng Z., and Chu C., 2008, Mutations of genes in synthesis of the carotenoid precursors of ABA lead to pre-harvest sprouting and photo-oxidation in rice, Plant J., 54(2): 177-189
http://dx.doi.org/10.1111/j.1365-313X.2008.03411.x PMid:18208525 PMCid:2327239
Fraser P.D., and Bramley P.M., 2004, The biosynthesis and nutritional uses of carotenoids, Prog. Lipid Res., 43(3): 228-265
http://dx.doi.org/10.1016/j.plipres.2003.10.002 PMid:15003396
Geourjon C., and Deléage G., 1995, SOPMA: Significant im- provement in protein secondary structure prediction by consensus prediction from multiple alignments, Computer Applications in the Biosciences, 11(6): 681-684
Grune T., Lietz G., Palou A., Ross A.C., Stahl W., Tang G., Thurnham D., Yin S., and Biesalski H.K., 2010, β-Carotene is an important Vitamin A source for humans, J. Nutr., 140(12S): 2268-2285
http://dx.doi.org/10.3945/jn.109.119024 PMid:20980645 PMCid:3139236
Hirschberg J., 2001, Carotenoid biosynthesis in flowering plants, Curr. Opin. Plant Biol., 4(3): 210-218
http://dx.doi.org/10.1016/S1369-5266(00)00163-1
Howitt C.A., and Pogson B.J., 2006, Carotenoid accumulation and function in seeds and non-green tissues, Plant Cell Environ., 29(3): 435-445
http://dx.doi.org/10.1111/j.1365-3040.2005.01492.x PMid:17080597
Huang B.C., Ji J., Wang G., and Zheng Y.X., 2006, Advances of carotenoid in plants, Tianjin Nongye Kexue (Tianjin Agricultural Sciences), 12(2): 13-17 (黄彬城, 季静, 王罡, 郑阳霞, 2006, 植物类胡萝卜素的研究进展, 天津农业科学, 12(2): 13-17)
Ji J., Wang G., Wang J.H., and Wang P., 2009, Functional analysis of multiple carotenogenic genes from Lycium barbarum and Gentiana lutea L. for their effects on β-carotene production in transgenic tobacco, Biotechnol. Lett., 31(2): 305-312
http://dx.doi.org/10.1007/s10529-008-9861-8 PMid:18936881
Müller K., Carpenter K.L.H., Challis I.R., Skepper J.N., and Arends M.J., 2002, Carotenoids induce apoptosis in the T-lymphoblast cell line Jurkat E6.1, Free Radic. Res., 36(7): 791-802
http://dx.doi.org/10.1080/10715760290032539 PMid:12180130
Palozza P., Serini S., Torsello A., Boninsegna A., Covacci V., Maggiano N., Ranelletti F.O., Wolf F.I., and Calviello G., 2002, Regulation of cell cycle progression and apoptosis by β-carotene in undifferentiated and differentiated HL-60 leukemia cells: Possible involvement of a redox mech- anism, Int. J. Cancer., 97(5): 593-600
http://dx.doi.org/10.1002/ijc.10094 PMid:11807783
Qi C.Z., Yuan Z.Z., and Li Y.X., 1983, A new type of cucumber Cucumis sativus L. var. xishuangbannanesis, Yuanyi Xuebao (Acta Horticulturae Sinica), 10(4): 259-264 (戚春章, 袁珍珍, 李玉湘, 1983, 黄瓜新类型—西双版纳黄瓜, 园艺学报, 10(4): 259-264)
Rodrigo M.J., Marcos J.F., and Zacarías L., 2004, Biochemical and molecular analysis of carotenoid biosynthesis in flavedo of orange (Citrus sinensis L.) during fruit develop- pment and maturation, J. Agric. Food Chem., 52(22): 6724-6731
http://dx.doi.org/10.1021/jf049607f PMid: 15506808
Romer S., and Fraser P.D., 2005, Recent advances in carotenoid biosynthesis, regulation and manipulation, Planta, 221(3): 305-308
http://dx.doi.org/10.1007/s00425-005-1533-5 PMid:15834583
Schwartz S.H., Qin X., and Zeevaart J.A.D., 2003, Elucidation of the indirect pathway of abscisic acid biosynthesis by mutants, genes, and enzymes, Plant Physiol., 131(4): 1591-1601
http://dx.doi.org/10.1104/pp.102.017921 PMid: 12692318 PMCid:1540303
Shen D., 2009, Analysis of population genetic diversity in Cucumis sativus L. var. xishuangbannaesis and study on the QTL mapping of fruit flesh color in cucumber, Dissertation for Ph.D., Institute of Vegetables and Flowers CAAS, Supervisor: Fang Z.Y., pp.46-49 (沈镝, 2009, 西双版纳黄瓜群体遗传多样性分析及黄瓜果肉色QTL定位研究, 博士学位论文, 中国农业科学院研究生院, 导师: 方智远, pp.46-49)
Sun X.Q., 2008, Studies of construction of overexpression vectors containing rubisCO activase gene (RCA) and genetic transformation, Thesis for M.S., College of Horticulture Science and Engineering, Shandong Agricul- tural University, Supervisor: Ai X.Z., pp.13-14 (孙晓琦, 2008, 黄瓜RubisCO活化酶基因(RCA)正义表达载体的构建及其遗传转化的研究, 硕士学位论文, 山东农业大学, 导师: 艾希珍, pp.13-14)
Yan P., Gao X.Z., Shen W.T., Zhou P., and Wang C., 2011, Cloning and expression analysis of phytoene desaturase and ζ-carotene desaturase genes in Carica papaya, Mol. Biol. Rep., 38(2): 785-791
http://dx.doi.org/10.1007/s11033-010-0167-2 PMid:20401696
.png)
.png)
.png)
.png)
.png)